
Кишечная микробиота человека. Мир внутри
Планета Земля является домом для триллионов по-своему уникальных живых существ. Представьте себе другой мир, заселенный причудливыми созданиями, которые, как и на Земле, постоянно находятся во взаимодействии друг с другом и окружающей средой. В сознании возникает другая планета, но никак не человек. Однако именно человеческое тело является местом обитания многочисленной популяции микроорганизмов. Это целая экосистема, настолько уникальная, что в мире не найдется двух людей с идентичным микробиомом.
Микробиом человека включает в себя микробиомы:
- кожи
- полости рта
- дыхательных путей
- урогенитального тракта
- кишечника
Наиболее разнообразным и густонаселенным микробиомом нашего тела является кишечный. Именно ему посвящена эта статья.
Что такое микробиота кишечника и зачем она нужна
Кишечная микробиота или, по-старому, микрофлора кишечника – это собирательное название микроорганизмов (бактерий, архей, грибов, протистов, водорослей), которые обитают в пищеварительном тракте людей и других животных (и даже насекомых). С человеком, как правило, сосуществуют бактерии, археи и грибы.
Отношения между человеком и его кишечной микробиотой характеризуются как комменсальные, которые выгодны для одного и нейтральны для другого и мутуалистические – взаимовыгодные и взаимозависимые отношения, при которых присутствие партнёра становится обязательным условием существования каждого из них.
Чем выгодны эти отношения для микробов? Мы предоставляем им “ночлег и пищу” – защищаем их от сурового внешнего мира и регулярно кормим, когда питаемся сами. Но какая польза от таких спутников человеку?
Основные функции кишечной микробиоты
Кишечные бактерии участвуют в извлечении энергии из пищи, производстве ключевых веществ для метаболизма хозяина, развитии иммунной системы, а также в защите от желудочно-кишечных инфекционных заболеваний.

Рисунок 1 – Основные функции нормальной микрофлоры.
Участие в пищеварении и производство метаболитов
Бактерии расщепляют компоненты пищи, которые человек не смог переварить собственными ферментами. Метаболизируют непереваренные углеводы (устойчивые формы крахмала, некоторые полисахариды и компоненты растительной клеточной стенки), синтезируя при этом необходимые составляющие нормального обмена веществ: органические кислоты, короткоцепочечные жирные кислоты (КЦЖК), витамины групп K и B, аминокислоты и экзополисахариды. Эти метаболиты всасываются в кровь или действуют непосредственно в кишечнике, оказывая положительное влияние на весь организм [1].
Модуляция иммунитета и защита кишечника
Незаменимая роль микробиоты заключается в поддержании барьерной функции кишечника и обеспечении местного иммунитета слизистой оболочки. Здоровая кишечная микробиота необходима для развития и «обучения» иммунных клеток, их активного функционирования в желудочно-кишечном тракте и во всём организме. Восприимчивость к многочисленным бактериальным, вирусным и паразитарным инфекциям увеличивается в результате потери колонизационной резистентности и нарушения иммунного ответа [2]. Кишечный эпителий – это основной посредник между иммунной системой и внешней средой. На развитие системы иммунитета хозяина влияют непрерывные и динамические взаимодействия с кишечной микробиотой и ее метаболитами. Бактерии являются неотъемлемой частью раннего развития иммунной системы кишечника и слизистых оболочек. Клетки кишечного эпителия предотвращают угрозы со стороны патогенов, передавая сигналы системе врожденного иммунитета через специфические рецепторы. Эти рецепторы распознают и связываются с определенными молекулами, связанными с бактериями, что приводит к выработке иммунного ответа хозяина и высвобождению защитных пептидов, цитокинов и лейкоцитов [3].
Колонизационная резистентность
Комменсальная микробиота конкурирует с патогенными бактериями за питательные вещества и места прикрепления в слизистой оболочке кишечника, продуцируя при этом противомикробные пептиды – бактериоцины. Тем самым, полезные микроорганизмы подавляют адгезию патогенных бактерий и защищают хозяина от инфицирования [2].
Пример: штамм Bacillus thuringiensis вырабатывает пептид турицин с противомикробным действием в отношении Clostridium difficile, который является главным возбудителем псевдомембранозного колита (тяжёлого инфекционного заболевания, часто возникающего в случае угнетения здоровой микробиоты кишечника из-за использования антибиотиков) [4].
Состав микробиома
Желудочно-кишечный тракт (ЖКТ) человека содержит разнообразное микробное сообщество, которое объединяет более 100 триллионов микроорганизмов [5]. Микробный состав варьируется в разных частях ЖКТ (рисунок 2) и зависит от анатомических областей кишечника, которые различаются с точки зрения физиологии, pH, доступности субстрата и секреции хозяина. Тонкий кишечник представляет собой сложную среду для колонизации микробами, учитывая довольно короткое время прохождения (3 – 5 часов) и высокую концентрацию желчи. В этой среде обычно присутствует относительно небольшое количество видов бактерий. Толстая же кишка характеризуется низкой скоростью потока и pH от нейтрального до умеренно кислого и является местом обитания наибольшего количества и разнообразия микроорганизмов с преобладанием строго анаэробных бактерий [6]. Концентрация бактериальных клеток в толстой кишке оценивается в сотни и тысячи миллиардов бактерий в 1 миллилитре, что делает толстую кишку одной из наиболее густонаселенных микробных сред обитания на Земле [7].

Рисунок 2 – Преобладающие роды бактерий в ротовой полости, пищеводе, желудке, тонком и толстом отделах кишечника [8].
Микробиота может состоять из сотен видов различных микроорганизмов (рис. 3). Доминирующими типами кишечных микробов являются Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria и Verrucomicrobia. У взрослого человека преобладают бактерии двух типов: Firmicutes и Bacteroidetes, которые представляют 90% микробиоты кишечника [9]. Тип Firmicutes состоит из более чем 200 различных родов, таких как Lactobacillus, Bacillus, Clostridium, Enterococcus и Ruminicoccus. Тип Bacteroidetes представлен преобладающими родами Bacteroides и Prevotella. Тип Actinobacteria пропорционально менее многочислен и в основном представлен родом Bifidobacterium [10].

Рисунок 3 – Примеры таксономического состава микробиоты кишечника. В рамке приведены примеры бактерий, принадлежащих к Firmicutes и Bacteroidetes, которые составляют 90% микробиоты кишечника. Источник [11].
Факторы, влияющие на состав микробиоты
Состав кишечной микробиоты отличается у разных людей и может меняться у одного и того же человека в течение жизни. Состав микробиоты зависит от многих факторов, таких как энтеротип, пол, возраст, диета, культурные привычки, образ жизни и здоровье человека.
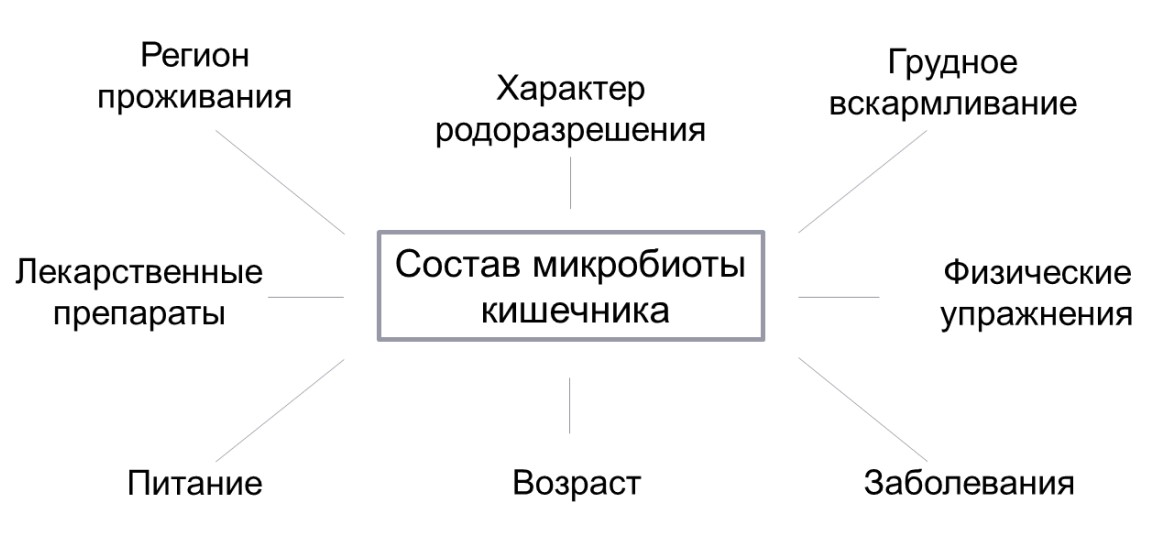
Рисунок 4 – Факторы, которые влияют на состав и функции микробиоты кишечника человека.
Энтеротип
В 2011 году были опубликованы результаты исследований европейских ученых, пытавшихся выявить устойчивые типы кишечной микробиоты. Они определили, что микробиота кишечника каждого человека характеризуется соотношениями бактерий, называемых энтеротипами. В зависимости от того, какое семейство и род бактерий доминирует в микробиоте, все профили можно условно разделить на три вида: Bacteroides (энтеротип I), Prevotella (энтеротип II) или Ruminococcus (энтеротип III). Эти три энтеротипа, по-видимому, не зависят от индекса массы тела, возраста, пола или национальности [10,12] и в большей степени связаны с типом питания.
Каждый энтеротип имеет свойственный ему род бактерий и отличается соотношением отдельных представителей данного вида микроорганизмов. Бактерии, принадлежащие к роду Bacteroides, хорошо расщепляют углеводы, в большом количестве синтезируют протеолитические ферменты и витамины (C, B2, B5, H). Такой энтеротип встречается в микробиоте любителей западной диеты (высокое потребление животного белка и жира и низкое потребление клетчатки). Часть бактерий рода Ruminococcus улучшают усвояемость полисахаров, расщепляют целлюлозу, обеспечивают организм витаминами B1 и В9. Данный энтеротип встречается у тех, кто в основном потребляет злаки и крахмалистые продукты. У любителей овощей, фруктов и сладостей часто доминирует род Prevotella. Причиной высокого уровня Prevotella может быть диета богатая клетчаткой. В то же время этот род связан с большим содержанием не только сложных углеводов, но и простых сахаров.
Изначально предполагалось, что энтеротипы станут своего рода идентификаторами, наподобие групп крови или отпечатков пальцев. Однако в ряде последующих исследований либо находили лишь частичное подтверждение существования энтеротипов [12,13], либо утверждалось обратное, что кластеров микробиоты не существует, а стоит говорить о непрерывном градиенте сообществ, то есть границы энтеротипов весьма размыты [14,15]. Поэтому сейчас среди ученых ведутся дискуссии о целесообразности разделения кишечной микробиоты на энтеротипы.
Пол
С самого первого дня жизни микробиота кишечника начинает формироваться в зависимости от пола, показывая различия в составе. У детей имеются значительные различия в количестве Actinobacteria, Firmicutes и Bacteroidetes с более высоким соотношением Bacteroidetes/Firmicutes у мальчиков по сравнению с девочками. Вероятно, динамические изменения половых гормонов, таких как пик тестостерона на раннем постнатальном этапе у мальчиков или в период полового созревания может быть основной причиной наблюдаемых различий. Исследования, проведенные среди взрослого населения, показали, что мужчины и женщины поддерживают разное количество типов микробиоты кишечника (Firmicutes, Verrucomicrobia, Bacteroidetes, Prevotella, Fusobacteria и Actinobacteria). Таким образом, стабильные уровни половых гормонов могут играть важную роль в формировании микробиома кишечника [16].
Возраст
Считается, что кишечник ребенка, пока он находится в утробе матери, стерилен и лишен бактерий, а его заселение бактериями происходит позже, после рождения. Однако появились данные о том, что первые бактерии попадают в организм человека еще до его рождения. Ученые обнаружили, что в плаценте, околоплодных водах, пуповинной крови и в меконии (первородном кале) присутствуют бактерии родов Enterococcus, Escherichia, Leuconostoc, Lactococcus и Streptococcus [17–19].
Характер родов
Однако самое масштабное заселение кишечника микроорганизмами происходит во время и сразу после родов, и для здоровья ребенка очень важно, как это будет происходить. При вагинальных родах, новорожденные приобретают состав микробиоты, напоминающий микробиоту влагалища их матери (Lactobacillus, Prevotella и Sneathia). Микробиота детей, рожденных естественным путем, характеризуется преобладающими группами бифидобактерий, такими как Bifidobacterium longum и Bifidobacterium catenulatum [20,21]. В свою очередь, младенцы, рожденные с помощью кесарева сечения, приобретают бактерии, полученные из больничной среды и кожи матери: Staphylococcus, Corynebacterium, Propionibacterium spp. Такая микробиота менее разнообразна с точки зрения видов бактерий, чем микробиота рожденных через естественные родовые пути [22]. С четырех месяцев различия в бактериальном разнообразии с естественно рожденными детьми начинают стираться и портреты микробиоты становятся всё более похожими, кроме одного рода комменсальных бактерий — Bacteroides. Эти бактерии отсутствуют или присутствуют в очень малых количествах почти у всех детей после кесарева сечения. Девять месяцев спустя, в среднем, около 60% всех исследуемых детей всё еще имели мало или не имели вовсе этих бактерий в своем кишечнике [23].
У детей, рожденных путем кесарева сечения, риск развития ожирения, астмы и других заболеваний несколько выше, чем у детей, рожденных естественным образом. Такие результаты часто объясняют разницей в микробиомах.
Кормление
Кормление младенцев играет одну из основных ролей в формировании микробиоты. Исследования показали, что дети, находящиеся на искусственном вскармливании, чаще колонизируются Escherichia coli, Bacteroides и Clostridium difficile по сравнению с теми, кого кормят грудью [24]. Дело в том, что грудное молоко – это оптимально сбалансированная пища для младенца, способствующая формированию «здорового» микробиома [25]. В первые дни жизни именно молоко матери защищает ребенка от инфекционных болезней и способствует снижению смертности от них [26] за счет содержания множества иммунных факторов: Т- и В-лимфоцитов, плазматических клеток, иммуноглобулинов (в первую очередь IgА) и антимикробных ферментов (лизоцима и лактоферрина). Вдобавок к этому, младенцы, которых кормили грудным молоком, обычно имели более высокое содержание и разнообразие Bifidobacterium spp., чем младенцы, которых кормили специальными смесями [24,27].
Введение твердой пищи и прекращение грудного вскармливания совпадают с основными изменениями микробиоты кишечника. В ней начинают преобладать Bifidobacterium, Clostridium coccoides и Bacteroides. Микробиота детей, находящихся на грудном вскармливании, и микробиота детей, ранее вскармливаемых молочными смесями, становятся более похожими друг на друга. Диетические привычки, отлучение младенцев от груди, методы кормления становятся определяющими и играют решающую роль в вариациях кишечной микробиоты. Введение продуктов с высоким содержанием клетчатки и углеводов вызывает увеличение Firmicutes и Prevotella, тогда как введение продуктов с высоким содержанием животного белка вызывает увеличение Bacteroidetes [28]. Ученые выяснили, что те, у кого представленность Prevotella выше, чем Bacteroides, обладают меньшим риском развития ожирения и диабета 2 типа [29].
В возрасте одного года в микробиоте ребенка характерно изобилие Akkermansia muciniphila, Bacteroides, Veillonella, Clostridium coccoides spp. и Clostridium botulinum spp. [30].

Рисунок 5– Факторы, обеспечивающие формирование микробиома младенца. Инфекции половых путей женщины могут привести к бактериальному загрязнению матки. Микрофлора кишечника и ротовой полости может транспортироваться с кровью к плоду. Характер родоразрешения формирует первичную микрофлору. Генетика и постнатальные факторы, такие как режим питания, использование антибиотиков и воздействие окружающей среды оказывают дополнительное влияние на микробиом [31]
Разнообразие микробиоты увеличивается с возрастом, пока не станет стабильным составом характерным для взрослых людей. В такой микробиоте будут доминировать три бактериальных типа: Firmicutes (Lachnospiraceae и Ruminococcaceae), Bacteroidetes (Bacteroidaceae, Prevotellaceae и Rikenellaceae и Actinobacteria (Bifidobacteriaceae и Coriobacteriaceae). Такой состав является результатом влияния генетики, окружающей среды, диеты, образа жизни и физиологии кишечника. Приблизительно в возрасте трех лет состав и разнообразие кишечной микробиоты ребенка больше всего похожи с таковыми у взрослых [32]. Что касается пожилых людей, на состав их кишечной микробиоты могут влиять пищеварение и изменение всасывания питательных веществ, а также ослабление иммунной активности. Подвижность кишечника снижается с возрастом, что приводит к увеличению времени транзита, и, таким образом, изменяется динамика оборота питательных веществ. У пожилых людей обычно уменьшено количество зубов и снижена сила жевания, что отражается на их диете [33]. Питание становится однообразным, что приводит к ограниченному диапазону пищевых ингредиентов для поддержки роста микробов. В связи с чем у пожилых людей снижено видовое разнообразие кишечной микробиоты. Наблюдается уменьшение количества анаэробных бактерий, таких как Bifidobacterium spp. и увеличение количества Clostridium и Proteobacteria [34].
Диетические и культурные привычки
Особое влияние на микробный состав кишечника оказывает образ жизни и выбор питания. Так, например, ученые сравнили составы кишечных микробиот африканских охотников-собирателей народа Хадза и итальянцев [35]. Кишечная микробиота Хадза в значительной степени обогащена протеобактериями и спирохетами, которые практически не обнаруживались в итальянской кишечной микробиоте. В то время как актинобактерии, важный субдоминирующий компонент итальянской кишечной микробиоты, почти отсутствуют у представителей африканского народа. Африканская диета содержит очень мало липидов и животных белков, но богата просом/сорго и местными овощами. Это приводит к тому, что микробиота кишечника Хадза сравнительно обогащена Prevotella, Eubacterium, Oscillibacter, Butyricicoccus, Sporobacter, Succinivibrio и Treponema и, соответственно, обеднены Bifidobacterium, Bacteroides, Blautia, Dorea, что соответствует энтеротипу II. Несмотря на это, диета может изменить микробиоту человека достаточно быстро.
В другом исследовании [36] ученые сравнили микробиом людей, придерживающихся растительной диеты (высокое содержание клетчатки и низкое содержание жиров и белков), с микробиомом тех, кто в основном употреблял продукты животного происхождения (низкое содержание клетчатки и высокое содержание жиров и белков). Они обнаружили, что переход к животной пище увеличивает количество устойчивых к желчи микроорганизмов (Alistipes, Bilophila и Bacteroides) и снижает уровни Firmicutes, которые метаболизируют полисахариды пищевых растений. Более того, при изменении диеты микробная активность может измениться в течение нескольких дней. Таким образом, микробиом кишечника может быстро реагировать на изменение диеты, потенциально способствуя разнообразию диетического образа жизни человека [36].
Микробиота при болезнях
Многие научные работы [11,37] показали взаимосвязь болезней человека с дисбиотическими процессами в кишечнике (атеросклероз, ожирение, сахарный диабет 2-го типа, воспалительные заболевания кишечника, синдром раздраженного кишечника, хроническая обструктивная болезнь легких, атопические заболевания, депрессия, аутизм, аутоиммунные заболевания и др.). Для некоторых заболеваний уже определены микробиотные маркеры. Например, воспалительные заболевания кишечника вызваны повышением количества Enterobacteria, Proteobacteria, адгезивной E. coli и дефицитом Clostridium coccoides, Faecalibacterium, при ассоциированной с антибиотиками диареи увеличивается количество Clostridium difficile и Klebsiella oxytoca, синдром раздраженного кишечника связан с избытком Cl. coccoides, Veillonella, Eubacterium rectale и дефицитом Bifidobacterium и Faecalibacterium. Таким образом, имеется возможность диагностики, профилактики и лечения различных патологий с помощью коррекции нашего микробиома.
Вывод
Микробиота кишечника человека развивается на протяжении всей жизни и, по-видимому, играет ключевую роль как в здоровом состоянии, так и при болезнях. В здоровом состоянии микробиота кишечника выполняет множество положительных функций, включая извлечение энергии в результате метаболизма непереваренных компонентов пищи, защиту организма хозяина от патогенного вторжения и модуляцию иммунной системы. Здоровая микробиота противодействует избыточному росту популяций условно-патогенных видов нормобиоты, формирует взаимоотношения с макроорганизмом, активно участвует в процессах ферментации, синтеза, детоксикации и иммуностимуляции.
Микробиота кишечника – это неотъемлемая часть нашего тела, которую мы получаем при рождении. Её состав сильно зависит от образа жизни и оказывает влияние на весь организм. И от того, какой будет микробиота, зависит качество и продолжительность нашей жизни.
Используемая литература
- Cao Y. et al. Impact of food additives on the composition and function of gut microbiota: A review // Trends Food Sci. Technol. Elsevier, 2020. Vol. 99, № February. P. 295–310.
- Wardwell L.H., Huttenhower C., Garrett W.S. Current Concepts of the Intestinal Microbiota and the Pathogenesis of Infection // Curr. Infect. Dis. Rep. 2011. Vol. 13, № 1. P. 28–34.
- Bull M.J., Plummer N.T. Part 1: The Human Gut Microbiome in Health and Disease. // Integr. Med. (Encinitas). 2014. Vol. 13, № 6. P. 17–22.
- Rea M.C. et al. Thuricin CD, a posttranslationally modified bacteriocin with a narrow spectrum of activity against Clostridium difficile // Proc. Natl. Acad. Sci. 2010. Vol. 107, № 20. P. 9352–9357.
- Thursby E., Juge N. Introduction to the human gut microbiota // Biochem. J. 2017. Vol. 474, № 11. P. 1823–1836.
- Knight D.J.W., Girling K.J. Gut flora in health and disease [9] // Lancet. 2003. Vol. 361, № 9371. P. 1831.
- Ley R.E. et al. Human gut microbes associated with obesity // Nature. 2006. Vol. 444, № 7122. P. 1022–1023.
- Ruan W. et al. Healthy Human Gastrointestinal Microbiome: Composition and Function After a Decade of Exploration // Dig. Dis. Sci. Springer US, 2020. Vol. 65, № 3. P. 695–705.
- Rajilić-Stojanović M. et al. Development and application of the human intestinal tract chip, a phylogenetic microarray: Analysis of universally conserved phylotypes in the abundant microbiota of young and elderly adults // Environ. Microbiol. 2009. Vol. 11, № 7. P. 1736–1751.
- Arumugam M. et al. Enterotypes of the human gut microbiome // Nature. 2011. Vol. 473, № 7346. P. 174–180.
- Rinninella E. et al. What is the healthy gut microbiota composition? A changing ecosystem across age, environment, diet, and diseases // Microorganisms. 2019. Vol. 7, № 1.
- Wu G.D. et al. Linking long-term dietary patterns with gut microbial enterotypes // Science (80-. ). 2011. Vol. 334, № 6052. P. 105–108.
- Wang J. et al. A metagenome-wide association study of gut microbiota in type 2 diabetes // Nature. Nature Publishing Group, 2012. Vol. 490, № 7418. P. 55–60.
- Jeffery I.B. et al. Categorization of the gut microbiota: Enterotypes or gradients? // Nat. Rev. Microbiol. Nature Publishing Group, 2012. Vol. 10, № 9. P. 591–592.
- Gorvitovskaia A., Holmes S.P., Huse S.M. Interpreting prevotella and bacteroides as biomarkers of diet and lifestyle // Microbiome. Microbiome, 2016. Vol. 4. P. 1–12.
- Valeri F., Endres K. How biological sex of the host shapes its gut microbiota // Front. Neuroendocrinol. Elsevier Inc., 2021. Vol. 61. P. 100912.
- Ardissone A.N. et al. Meconium microbiome analysis identifies bacteria correlated with premature birth // PLoS One. 2014. Vol. 9, № 3. P. 1–8.
- Moles L. et al. Bacterial Diversity in Meconium of Preterm Neonates and Evolution of Their Fecal Microbiota during the First Month of Life // PLoS One. 2013. Vol. 8, № 6.
- DiGiulio D.B. et al. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: A molecular and culture-based investigation // PLoS One. 2008. Vol. 3, № 8. P. 1–10.
- Mueller N.T. et al. The infant microbiome development: mom matters // Trends Mol. Med. 2015. Vol. 21, № 2. P. 109–117.
- Dominguez-Bello M.G. et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns // Proc. Natl. Acad. Sci. U. S. A. 2010. Vol. 107, № 26. P. 11971–11975.
- Biasucci G. et al. Cesarean delivery may affect the early biodiversity of intestinal bacteria // J. Nutr. 2008. Vol. 138, № 9. P. 1796–1800.
- Jakobsson H.E. et al. Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by Caesarean section // Gut. 2014. Vol. 63, № 4. P. 559–566.
- Penders J. et al. Factors Influencing the Composition of the Intestinal Microbiota in Early Infancy // Pediatrics. 2006. Vol. 118, № 2. P. 511–521.
- Butte N., Lopez-Alaracon M., Garza C. Nutrient adequacy of exclusive breastfeeding for the term infant during the first six months of life // World Heal. Organ. 2002. P. 47.
- Effect of breastfeeding on infant and child mortality due to infectious diseases in less developed countries: a pooled analysis // Lancet. 2000. Vol. 355, № 9202. P. 451–455.
- Roger L.C. et al. Examination of faecal Bifidobacterium populations in breast- and formula-fed infants during the first 18 months of life // Microbiology. 2010. Vol. 156, № 11. P. 3329–3341.
- Tanaka M., Nakayama J. Development of the gut microbiota in infancy and its impact on health in later life // Allergol. Int. 2017. Vol. 66, № 4. P. 515–522.
- Kovatcheva-Datchary P. et al. Dietary Fiber-Induced Improvement in Glucose Metabolism Is Associated with Increased Abundance of Prevotella // Cell Metab. 2015. Vol. 22, № 6. P. 971–982.
- Tidjani Alou M., Lagier J.C., Raoult D. Diet influence on the gut microbiota and dysbiosis related to nutritional disorders // Hum. Microbiome J. Elsevier Ltd, 2016. Vol. 1. P. 3–11.
- Tamburini S. et al. The microbiome in early life: Implications for health outcomes // Nat. Med. Nature Publishing Group, 2016. Vol. 22, № 7. P. 713–722.
- Yatsunenko T. et al. Human gut microbiome viewed across age and geography // Nature. 2012. Vol. 486, № 7402. P. 222–227.
- O’Toole P.W., Claesson M.J. Gut microbiota: Changes throughout the lifespan from infancy to elderly // Int. Dairy J. Elsevier Ltd, 2010. Vol. 20, № 4. P. 281–291.
- Odamaki T. et al. Age-related changes in gut microbiota composition from newborn to centenarian: A cross-sectional study // BMC Microbiol. BMC Microbiology, 2016. Vol. 16, № 1. P. 1–12.
- Schnorr S.L. et al. Gut microbiome of the Hadza hunter-gatherers // Nat. Commun. Nature Publishing Group, 2014. Vol. 5.
- David L.A. et al. Diet rapidly and reproducibly alters the human gut microbiome // Nature. 2014. Vol. 505, № 7484. P. 559–563.
- Wang B. et al. The Human Microbiota in Health and Disease // Engineering. Elsevier LTD on behalf of Chinese Academy of Engineering and Higher Education Press Limited Company, 2017. Vol. 3, № 1. P. 71–82.
Владислав Орлов Биотехнологический информационный центр Артлайф


