
Антибиотики и кишечная микробиота
Природа – конкурентная и жестокая среда. За место под солнцем, за питание и ресурсы борются все виды живых организмов, от вирусов и бактерий до человека. Цена поражения – вымирание. Еще в незапамятные времена, когда жизнь еще даже не выбралась на сушу, в мировом океане кипела схватка между простыми организмами, а оружием им служили разнообразные химические вещества. Гораздо позднее на арену вступил человек с исключительным преимуществом – интеллектом. Он сумел обратить безжалостное микробное противостояние себе на пользу, избавившись от большинства смертоносных болезней.
Антибиотики – так сейчас называют подсказанное природой противопатогенное «оружие массового поражения». Без сомнения, это одно из величайших открытий человечества, однако, как и с любым оружием, с антибиотиками следует обращаться осторожно. Иначе бактерии нанесут ответный удар...
Что такое антибиотики?
Антибиотики (от др.-греч. ἀντί «против» + βίος «жизнь») — это препараты, применяемые для лечения бактериальных инфекций. Они могут убивать микроорганизмы или останавливать их размножение, позволяя естественным защитным механизмам (иммунитету) их устранять. В современной науке и в документах ВОЗ название «антибиотики» не используется, вместо него используется более корректное название этой группы лекарственных веществ — «противомикробные препараты».
Получают антибиотики, выделяя их из колоний бактерий, грибков, тканей растений и животных. Иногда выделенные вещества модифицируются учеными для изменения их свойств или даже синтезируются новые противомикробные препараты, не имеющие природных аналогов. Таким образом, антибиотики могут быть природными, полусинтетическими и синтетическими.
История создания антибиотиков
Упоминания об использовании плесневых грибков в лечебных целях встречаются в трудах древних учёных и философов. Например, в Древнем Египте, Китае и Индии плесневелый хлеб использовали для дезинфекции, прикладывая его к ранам и гнойникам [1,2].
В 19 веке сэр Джон Скотт Бёрден-Сандерсон заметил отсутствие бактерий в жидкой культуре, покрытой плесенью. В 1871 году Джозеф Листер обнаружил ингибирующее действие Penicillium glaucum на рост бактерий. В то же время Луи Пастер заметил, что одни бактерии могут подавлять другие. Он вместе со своим коллегой Жюлем Франсуа Жубером в 1877 году заметили, что подавлялся рост Bacillus anthracis в образцах мочи при совместном культивировании с «обычными» аэробными бактериями.
В 1897 году Эрнест Дюшен, работая с грибами рода Penicillium, опробовал плесень на морских свинках и обнаружил её разрушающее действие на палочку брюшного тифа. Дюшен представил диссертацию на соискание докторской степени, посвящённую «антагонизму между плесенью и микробами». Но его работа не привлекла внимания научного сообщества [3].
Первые обнаруженные противомикробные молекулы были химически синтезированными соединениями. В 1909 году Пол Эрлих открыл арсфенамин, производное мышьяка, действующее против Treponema pallidum, возбудителя сифилиса. Этот антибиотик в 1910 появился в продаже под названием Сальварсан. В 1930 году Герхард Домагк открыл антибиотические эффекты сульфаниламида, молекулы, синтезированной за 22 года до этого Полом Гельмо [4]. Этот антибиотик продавался под названием Prontosil в 1935 г. и использовался солдатами во время Второй мировой войны [5].

Рисунок 1 – Сальварсан («спасительный мышьяк»). «Ehrlichschen Präparat 606» — антисифилитический препарат, созданный Эрлихом и его коллегами.
В 1928 году Александр Флеминг обнаружил, что некоторые колонии золотистого стафилококка, оставленные им в лабораторных чашках, заражены штаммом плесени Penicillium Notatum. Вокруг пятен плесени Флеминг заметил область, в которой бактерий не было. Это позволило ему сделать вывод о том, что плесень вырабатывает убивающее бактерии вещество, которое было названо пенициллином. Однако промышленное производство этого антибиотика было осуществлено только в 1940 году Говардом Флори и Эрнст Чейн с использованием Penicillium chrysogenum [2].

Рисунок 2 – Фото чашки Петри из знаменитой статьи Александра Флеминга. Хорошо видна «мертвая зона» между бляшкой плесневого грибка и колониями бактерий [6].
В 1942 году в СССР советский микробиолог Зинаида Ермольева разработала первый отечественный антибиотик пенициллин и активно участвовала в организации промышленного производства антибиотика в условиях войны.
В США Селман Ваксман первым провел систематическое исследование антимикробной активности почвенных бактерий, особенно представителей стрептомицетов. Он разработал несколько методов и стратегий культивирования («платформа Ваксмана»), чтобы выявить антагонизм между видами бактерий [7]. Используя свою платформу, он открыл в 1940-х годах несколько основных антибиотиков и противогрибковых средств, таких как актиномицин (из Streptomyces spp.) [8], стрептомицин (из Streptomyces griseus) [9], неомицин (из Streptomyces fradiae) [10], фумигацин (из Aspergillus fumigatu) и клавацина (из Aspergillus clavatus) [11]. Фармацевтическая промышленность была вдохновлена платформой Ваксмана, которая привела к открытию всех современных антибиотиков в период с 1940-х по 1970-е годы. В этот золотой век было открыто более 20 классов антибиотиков из десятков видов бактерий и грибов.
Антибиотики и кишечная микробиота
Кишечник человека является средой обитания богатого и разнообразного сообщества микробов, состоящего из архей, бактерий, эукариот (грибов, гельминтов, простейших) и вирусов.
Антибиотики произвели революцию в медицине и спасли бесчисленное количество жизней. До их изобретения большинство людей умирало от инфекционных болезней. Достаточно было получить ушиб или порез, и это могло вызвать серьезные осложнения, нередко приводящие к смерти. Сейчас антибиотики относятся к числу наиболее часто назначаемых лекарств. Однако несмотря на их преимущества, приём антибиотиков приводит к нарушениям в кишечной микробиоте, включая изменение численности определенных таксонов бактерий, снижение защиты от колонизации потенциально патогенными (например, Enterobacteriaceae) или условно-патогенными (например, Clostridium difficile, Candida spp.) микроорганизмами. Происходит это из-за того, что антибактериальные препараты способны подавлять рост не только патогенных микроорганизмов, но и симбионтной микрофлоры, населяющей желудочно–кишечный тракт. Симбионтная микрофлора вырабатывает вещества с антибактериальной активностью, которые предотвращают внедрение патогенных микроорганизмов и развитие условно–патогенной флоры.
На этом фоне может возникнуть антибиотикоассоциированная диарея (ААД). ААД может варьироваться по степени тяжести от легкого заболевания до опасного для жизни состояния [12]. Наиболее тяжелое острое воспалительное заболевание кишечника, вызванное микроорганизмом Clostridium difficile и, как правило, связанное с применением антибиотиков, носит название «псевдомембранозный колит». Clostridium difficile – облигатно–анаэробная грамположительная спорообразующая бактерия, обладающая природной устойчивостью к большинству антибиотиков. Clostridium difficile способна длительное время сохраняться в окружающей среде.
У здоровых людей местная кишечная микробиота помогает поддерживать стабильную среду, конкурируя с экзогенными патогенами за питательные вещества, поверхностные рецепторы и физическое пространство, то есть обеспечивая колонизационную резистентность. Используемые антибиотики могут нарушить этот баланс, что приведет к колонизации патогенов и их чрезмерному росту, вызывая ААД. Антибиотики могут вызывать осмотическую диарею из-за накопления неферментированных молекул углеводов в просвете кишечника [13].
Многие исследования показывают, что антибиотики увеличивают количество энтеробактерий. Эти грамотрицательные бактерии часто устойчивы к бета-лактамным (пенициллины, цефалоспорины, карбапенемы) и другим антибиотикам. Это означает, что человек может стать более восприимчивым к инфекциям, вызванным устойчивыми к антибиотикам бактериями [14].
Антибиотикорезистентность и персистенция бактерий
Чрезмерное использование антибиотиков способствует развитию у микроорганизмов резистентности (устойчивости). Эпидемиологические исследования продемонстрировали прямую связь между потреблением антибиотиков и появлением и распространением устойчивых штаммов бактерий.
Основной вклад в развитие антибиотикорезистентности вносят: чрезмерный прием, неуместное назначение и широкое сельскохозяйственное использование антибиотиков.
Основные факты (по данным ВОЗ):
- Устойчивость к антибиотикам сегодня является одной из самых больших угроз для глобального здоровья и продовольственной безопасности;
- Устойчивость к антибиотикам может возникнуть у любого человека в любом возрасте и в любой стране;
- Устойчивость к антибиотикам возникает естественным образом, но неправильное использование антибиотиков (необоснованное применение, нарушение курса приема) у людей и животных ускоряет этот процесс;
- Растущее число инфекций, таких как пневмония, туберкулез, гонорея и сальмонеллез, становится все труднее лечить, поскольку антибиотики, используемые для их лечения, становятся менее эффективными;
- Устойчивость к антибиотикам приводит к более длительному пребыванию в больнице и повышенной смертности.
Антибиотик – это основной инструмент борьбы с инфекциями, и он становится бесполезным, если бактерия приобретает специализированные пути защиты или инактивации активной молекулы. Это явление крайне опасно. Так, при резистентности появляется новый штамм возбудителя, который имеет особые мутации, позволяющие ему активно размножаться даже в присутствии конкретного антибиотика. В такой ситуации этот антибактериальный препарат окажется совершенно неэффективным в лечении болезни – у пациента останутся все симптомы острой фазы инфекции.
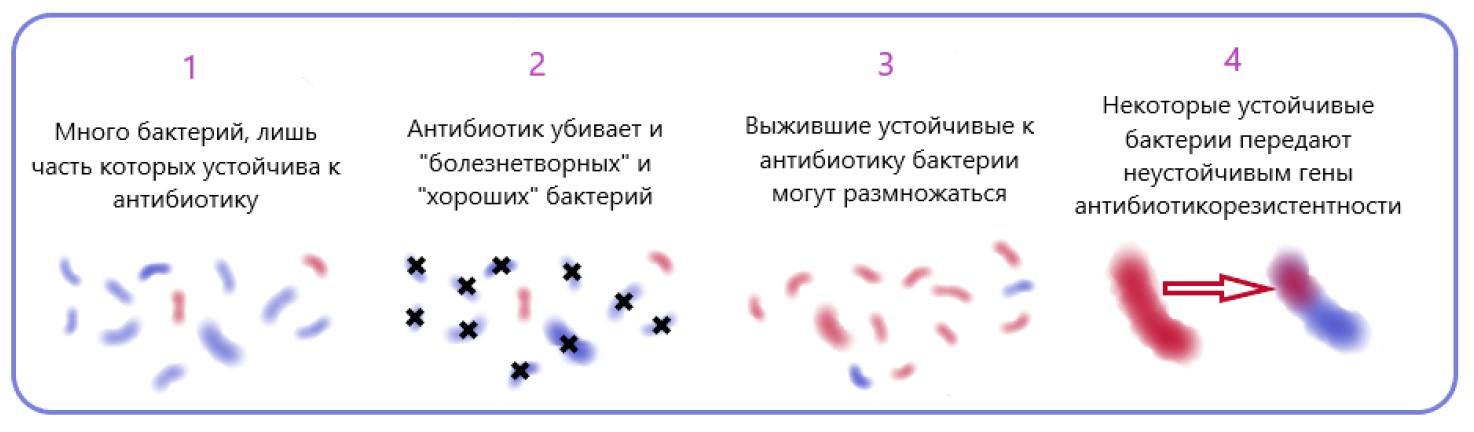
Рисунок 3 – Один из путей возникновения антибиотикорезистентности [29].
Пути распространения резистентности:
От сельскохозяйственных животных. Антибиотики специально добавляют в корм скоту – в основном, для того чтобы ускорить рост животных и предотвратить инфекции. Резистентные бактерии могут перейти к человеку непосредственно на ферме, либо через плохо приготовленные и не стерилизованные продукты питания. Также, отходы жизнедеятельности животных попадают в окружающую среду, где и оставшиеся антибиотики, и резистентные бактерии могут влиять на микроорганизмы, живущие в этой среде.
От растений. В растениеводстве широко применяют антибиотики, чтобы защитить растения от нежелательных патогенов, способных погубить весь урожай. Но если немного не рассчитать дозу используемого антибиотика, то может получиться устойчивый к нему микроорганизм. С недостаточно промытой и приготовленной пищей он попадает к человеку.
От человека к человеку. Носитель антибиотикорезистентного микроорганизма может распространять этот микроорганизм и заражать других людей, например, в общественных местах и больницах.
Из окружающей среды. В среду микроорганизм попадает вышеперечисленными путями, а через немытые руки или с плохо обработанной пищей может оказаться у человека.
Чем отличается персистенция от резистентности?
При резистентности бактерия изменяет свой геном, получая либо особые гены, которые позволяют ей инактивировать антибиотик (изменить его химически или удалить его из клетки), либо мутации, которые изменяют клеточную мишень антибиотика, делая её недоступной для атаки.
Клетки-персистеры, в свою очередь, представляют собой бактерии, которые сопротивляются лечению и становятся нечувствительными к противомикробным препаратам, переходя в состояние покоя [15,16]. Персистирующие клетки в состоянии покоя не размножаются [17]. Показанная толерантность клеток-персистеров отличается от устойчивости к противомикробным препаратам тем, что способность к персистенции не передается по наследству и является обратимой [18]. Когда лечение прекращается, состояние покоя может быть обращено вспять, и клетки могут реактивироваться и размножаться.
Благодаря этим механизмам бактерии могут переживать воздействие антибиотиков [19] и дают возможность эволюционировать в присутствии препарата [20], таким образом делая вклад в формирование резистентности и к классическим, и к современным антибиотикам.
Персистенция не даёт справиться с болезнью окончательно: в части случаев та же инфекция возобновляется спустя некоторое время даже после успешного первоначального лечения антибиотиками и отступления острой фазы инфекции [21].
С каждым днем темпы роста резистентности увеличиваются, и кризис здравоохранения в области антибиотиков будет только возрастать. Поэтому сейчас ученые и врачи активно ищут альтернативы традиционным антибиотикам. Для этой цели использование антимикробных пептидов может оказаться весьма эффективным.
Антимикробные пептиды. Бактериоцины
Распространение устойчивости к антибиотикам у бактерий, вызывающих инфекционные заболевания, привело к необходимости разработки новых методов лечения. Одним из наиболее перспективных является создание лекарств на основе бактериоцинов - небольших пептидов, подавляющих рост бактерий. Многие научные группы исследуют эти вещества, и в ближайшем будущем они могут стать альтернативой антибиотикам.
Бактериоцины – это большое семейство секретируемых бактериями пептидов, обладающих антимикробной активностью и действующих против других штаммов того же вида или близкородственных видов [22]. Антимикробные пептиды обладают несколькими способами действия с неспецифическими мишенями и менее склонны к выработке устойчивости [23,24].
Бактериоцины являются потенциальной альтернативой традиционным антибиотикам, благодаря своим качествам [25]:
- антимикробная активность;
- низкая токсичность;
- широкий и узкий спектр действия разных пептидов;
- возможность производства in situ пробиотиками.
Например, субтилозин, пептид, который продуцирует Bacillus spp. проявляет активность по отношению к близкородственным видам и Listeria monocytogenes. Как и все бактериоцины грамположительных бактерий, субтилозин убивает путем образования пор в мембранах чувствительных клеток [26]. Штаммы, продуцирующие этот бактериоцин, считаются потенциальными пробиотиками, так как способны подавлять рост болезнетворных бактерий, которые могут разрушать нашу кишечную микрофлору [27].
Считается, что бактериоцины можно использовать в качестве естественных консервантов продуктов питания. Один из них, а именно низин, выделяют из пробиотической бактерии Streptococcus lactis и используют в пищевых продуктах [28]. В связи с этим актуальной задачей является получение ценных метаболитов бактерий, обладающих многими полезными свойствами, в том числе противомикробным действием.
Метабиотики – это продукты метаболизма и клеточные стенки пробиотических бактерий, которые не только способствуют росту полезной микрофлоры, но и подавляют вредоносную, так как содержат в своем составе противомикробные пептиды (бактериоцины) и органические кислоты. При попадании в кишечник они начинают действовать немедленно, не требуя времени для активации и создают благоприятную среду для полезных бактерий и эпителия кишечника. Более того, метабиотики в отличие от живых бактерий не повреждаются при приёме антибиотиков.
Изучение класса противомикробных пептидов-бактериоцинов - лишь вопрос времени. Это дает надежду на появление достойного преемника антибиотиков, противомикробного "оружия" нового поколения. Бактериоцины могут стать более селективным, щадящим по отношению к человеку способом борьбы с патогенными бактериями.
Используемая литература:
- Pećanac M. et al. Burns treatment in ancient times // Med. Pregl. 2013. Vol. 66, № 5–6. P. 263–267.
- Durand G.A., Raoult D., Dubourg G. Antibiotic discovery: history, methods and perspectives // Int. J. Antimicrob. Agents. 2019. Vol. 53, № 4. P. 371–382.
- Shama G. La Moisissure et la Bactérie: Deconstructing the fable of the discovery of penicillin by Ernest Duchesne // Endeavour. 2016. Vol. 40, № 3. P. 188–200.
- Gelmo P. Über Sulfamide der p-Amidobenzolsulfonsäure // J. für Prakt. Chemie. 1908. Vol. 77, № 1. P. 369–382.
- Lewis K. Platforms for antibiotic discovery // Nat. Rev. Drug Discov. 2013. Vol. 12, № 5. P. 371–387.
- A. F. On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae // Br. J. Exp. Pathol. 1929. Vol. 10. P. 226–236.
- Lewis K. Recover the lost art of drug discovery // Nature. 2012. Vol. 485, № 7399. P. 439–440.
- Waksman S. A., Geiger W. B. R.D.M. Strain specificity and production of antibiotic substances: VII. Production of actinomycin by different actinomycetes // Proc. Natl. Acad. Sci. U. S. A. 1946. Vol. 32, № 5. P. 117.
- JONES D. et al. CONTROL OF GRAM-NEGATIVE BACTERIA IN EXPERIMENTAL ANIMALS BY STREPTOMYCIN // Science (80-. ). 1944. Vol. 100, № 2588. P. 103–105.
- Waksman S.A., Lechevalier H.A. Neomycin, a New Antibiotic Active against Streptomycin-Resistant Bacteria, including Tuberculosis Organisms // Science (80-. ). 1949. Vol. 109, № 2830. P. 305–307.
- WAKSMAN S.A., HORNING E.S., SPENCER E.L. THE PRODUCTION OF TWO ANTIBACTERIAL SUBSTANCES, FUMIGACIN AND CLAVACIN // Science (80-. ). 1942. Vol. 96, № 2487. P. 202–203.
- Rajkumar C. et al. Do probiotics prevent antibiotic-associated diarrhoea? Results of a multicentre randomized placebo-controlled trial // J. Hosp. Infect. 2020. Vol. 105, № 2. P. 280–288.
- Bartlett J.G. Antibiotic-associated diarrhea // Clin. Infect. Dis. Second Ed. 2015. Vol. 18, № 2. P. 349–351.
- Zimmermann P., Curtis N. The effect of antibiotics on the composition of the intestinal microbiota - a systematic review // J. Infect. Elsevier Ltd, 2019. Vol. 79, № 6. P. 471–489.
- Van den Bergh B., Fauvart M., Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters // FEMS Microbiol. Rev. 2017. Vol. 41, № 3. P. 219–251.
- Lewis K. Persister cells, dormancy and infectious disease // Nat. Rev. Microbiol. 2007. Vol. 5, № 1. P. 48–56.
- Brauner A. et al. Distinguishing between resistance, tolerance and persistence to antibiotic treatment // Nat. Rev. Microbiol. 2016. Vol. 14, № 5. P. 320–330.
- Jayaraman R. Bacterial persistence: some new insights into an old phenomenon // J. Biosci. 2008. Vol. 33, № 5. P. 795–805.
- Salcedo-Sora J.E., Kell D.B. A Quantitative Survey of Bacterial Persistence in the Presence of Antibiotics: Towards Antipersister Antimicrobial Discovery // Antibiotics. 2020. Vol. 9, № 8. P. 508.
- Sebastian J. et al. De Novo Emergence of Genetically Resistant Mutants of Mycobacterium tuberculosis from the Persistence Phase Cells Formed against Antituberculosis Drugs In Vitro // Antimicrob. Agents Chemother. 2017. Vol. 61, № 2.
- Lewis K. Persister Cells // Annu. Rev. Microbiol. 2010. Vol. 64, № 1. P. 357–372.
- De Vuyst L., Leroy F. Bacteriocins from Lactic Acid Bacteria: Production, Purification, and Food Applications // J. Mol. Microbiol. Biotechnol. 2007. Vol. 13, № 4. P. 194–199.
- Mookherjee N. et al. Antimicrobial host defence peptides: functions and clinical potential // Nat. Rev. Drug Discov. 2020. Vol. 19, № 5. P. 311–332.
- Rončević T., Puizina J., Tossi A. Antimicrobial Peptides as Anti-Infective Agents in Pre-Post-Antibiotic Era? // Int. J. Mol. Sci. 2019. Vol. 20, № 22. P. 5713.
- Cotter P.D., Ross R.P., Hill C. Bacteriocins — a viable alternative to antibiotics? // Nat. Rev. Microbiol. 2013. Vol. 11, № 2. P. 95–105.
- Thennarasu S. et al. Membrane permeabilization, orientation, and antimicrobial mechanism of subtilosin A // Chem. Phys. Lipids. 2005. Vol. 137, № 1–2. P. 38–51.
- Khochamit N. et al. Antibacterial activity and genotypic–phenotypic characteristics of bacteriocin-producing Bacillus subtilis KKU213: Potential as a probiotic strain // Microbiol. Res. 2015. Vol. 170. P. 36–50.
- Barbosa A.A.T., Mantovani H.C., Jain S. Bacteriocins from lactic acid bacteria and their potential in the preservation of fruit products // Crit. Rev. Biotechnol. 2017. Vol. 37, № 7. P. 852–864.
- Потапова Н. Антибиотики и антибиотикорезистентность: от древности до наших дней [Электронный ресурс]. 2017. URL: https://biomolecula.ru/articles/antibiotiki-i-antibiotikorezistentnost-ot-drevnosti-do-nashikh-dnei.
Владислав Орлов Биотехнологический информационный центр Артлайф


